Modelos Atómicos:
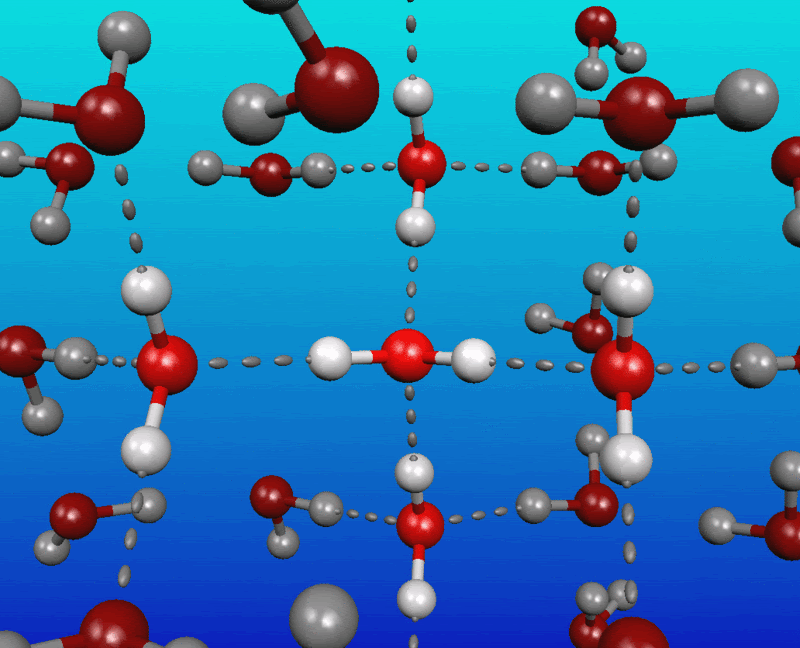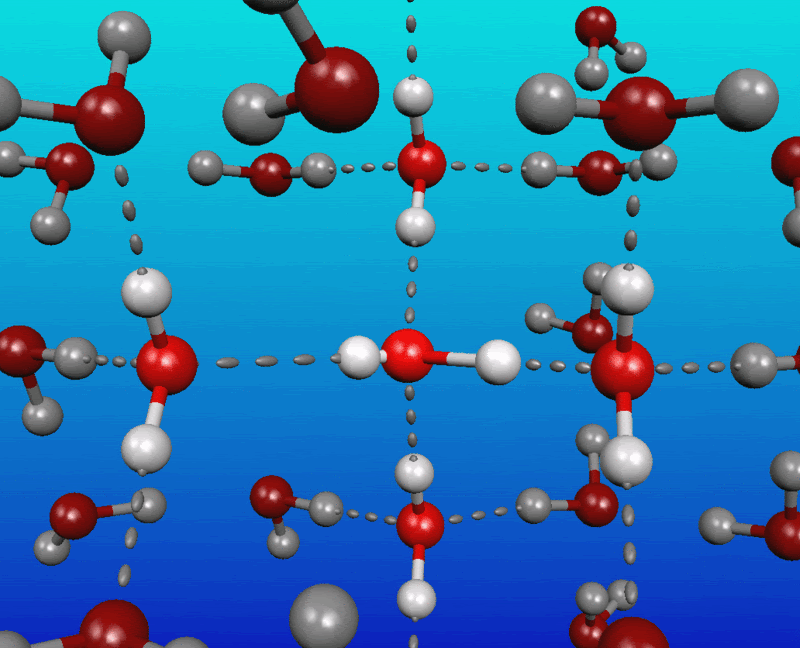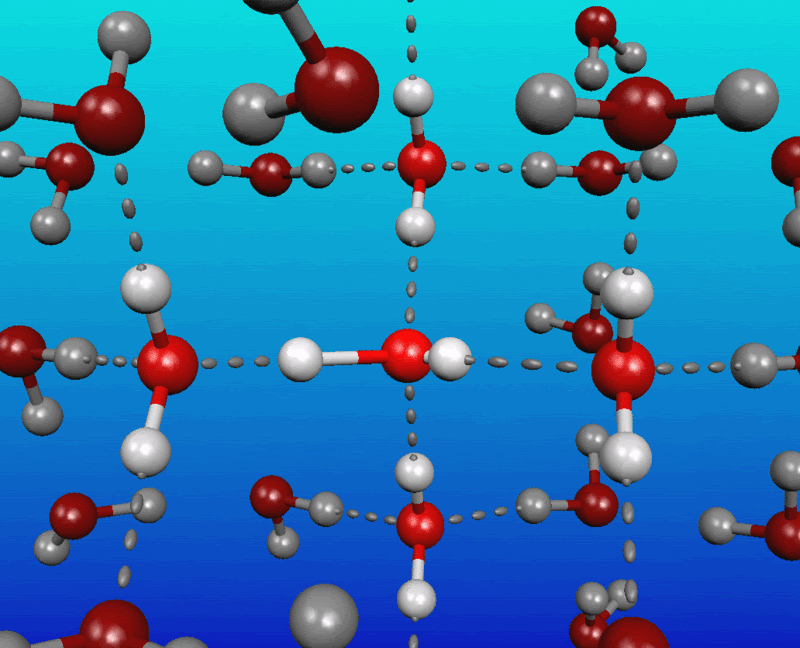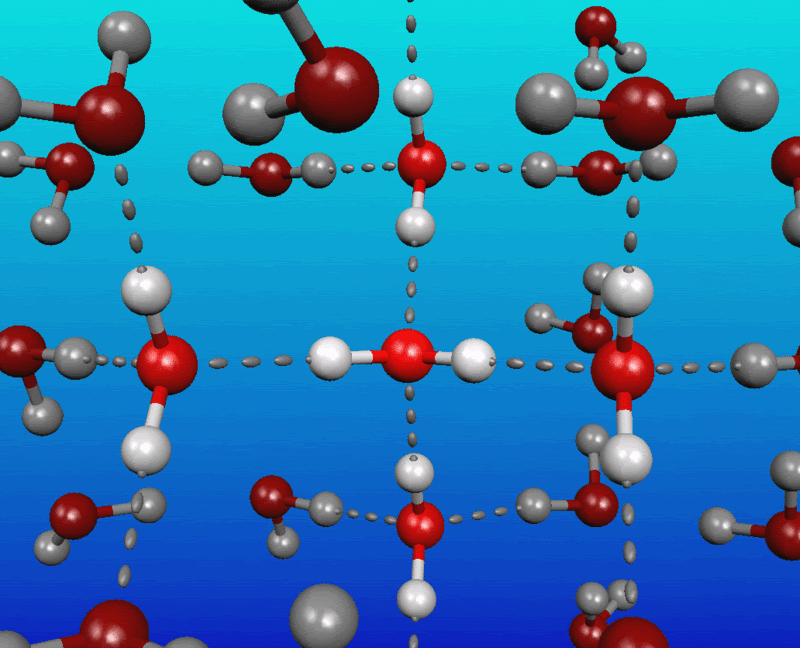
Modelo de Dalton:

En 1913 Niels Bohr, desarrolló su célebre modelo atómico de acuerdo a cuatro postulados fundamentales:
1. Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
2. Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios.
3. El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un único cuanto de luz (fotón) cuya energía corresponde a la diferencia de energía entre ambas órbitas.
4. Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbital L de acuerdo con una simple ecuación.
Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo.

Modelo de Dalton:

Dalton tomo como punto de partida una serie de evidencias experimentales conocidas en su época:
* Las sustancias elementales no pueden descomponerse.
* Las sustancias, simples o compuestas, tienen siempre las mismas propiedades características.
* Los elementos no desaparecen al formarse un compuesto, pues se pueden recuperar por descomposición de éste.
* La masa se conserva en las reacciones químicas, que provenía de la Ley de conservación de la masa del químico francés Lavoisier.
* La proporción de los elementos que forman un compuesto es constante, que provenía de la Ley de las proporciones definidas del también químico francés Proust.
Para explicar estos hechos propuso las siguientes hipótesis:
* La masa es discontinua; esta formada por átomos que son particulas indivisibles.
* Todos los átomos de un mismo elemento son iguales, tienen la misma masa y átomos de diferentes elementos difieren en su masa.
* Los átomos de diferentes elementos se combinan para formar "átomos compuestos".
* Los cambios químicos son cambios en las combinaciones de los átomos entre si, los átomos no se crean ni se destruyen
* Los átomos que se combinan para formar un compuesto lo hacen siempre en la misma proporción, es decir, que todos los "átomos compuestos" de una misma sustancia son iguales, que será la Ley de las proporciones múltiples.
La contribución de Dalton no fue proponer una idea asombrosamente original, sino formular claramente una serie de hipótesis sobre la naturaleza de los átomos que señalaban la masa como una de sus propiedades fundamentales, y preocuparse por probar tales ideas mediante experimentos cuantitativos.
* Las sustancias elementales no pueden descomponerse.
* Las sustancias, simples o compuestas, tienen siempre las mismas propiedades características.
* Los elementos no desaparecen al formarse un compuesto, pues se pueden recuperar por descomposición de éste.
* La masa se conserva en las reacciones químicas, que provenía de la Ley de conservación de la masa del químico francés Lavoisier.
* La proporción de los elementos que forman un compuesto es constante, que provenía de la Ley de las proporciones definidas del también químico francés Proust.
Para explicar estos hechos propuso las siguientes hipótesis:
* La masa es discontinua; esta formada por átomos que son particulas indivisibles.
* Todos los átomos de un mismo elemento son iguales, tienen la misma masa y átomos de diferentes elementos difieren en su masa.
* Los átomos de diferentes elementos se combinan para formar "átomos compuestos".
* Los cambios químicos son cambios en las combinaciones de los átomos entre si, los átomos no se crean ni se destruyen
* Los átomos que se combinan para formar un compuesto lo hacen siempre en la misma proporción, es decir, que todos los "átomos compuestos" de una misma sustancia son iguales, que será la Ley de las proporciones múltiples.
La contribución de Dalton no fue proponer una idea asombrosamente original, sino formular claramente una serie de hipótesis sobre la naturaleza de los átomos que señalaban la masa como una de sus propiedades fundamentales, y preocuparse por probar tales ideas mediante experimentos cuantitativos.
Modelo de Milikan:

Robert Millikan

Robert Millikan
Se denomina experimento de Millikan o experimento de la gota de aceite al experimento realizado por primera vez en 1909 por el físico estadounidense Robert Millikan y que le permitió medir la carga del electrón.
El experimento consiste en introducir en un gas, gotitas de aceite de un radio del orden de un micrómetro. Estas gotitas caen muy lentamente, con movimiento uniforme, con su peso compensado por la viscosidad del medio. Este tipo de movimiento viene regido por la ley de Stokes. Ahora bien, las gotas se cargan electrostáticamente al salir del atomizador por lo que su movimiento de caída se altera significativamente si se hace actuar un campo eléctrico vertical. Ajustando convenientemente la magnitud del campo eléctrico, puede lograrse que la gota permanezca en suspensión.
Conociendo el valor m de la masa de la gota, la intensidad E del campo eléctrico y el valor g de la gravedad, puede calcularse la carga q de la gota en equilibrio:
mg = qE

Millikan comprobó que los valores de las cargas eran siempre múltiplos de una carga elemental, la del electrón. Por consiguiente pudo medir la carga eléctrica que posee un electrón. Este valor es:
e = 1,602 × 10-19 culombios.
Millikan recibió el premio Nobel de Física en 1923 en parte por este experimento.
El experimento consiste en introducir en un gas, gotitas de aceite de un radio del orden de un micrómetro. Estas gotitas caen muy lentamente, con movimiento uniforme, con su peso compensado por la viscosidad del medio. Este tipo de movimiento viene regido por la ley de Stokes. Ahora bien, las gotas se cargan electrostáticamente al salir del atomizador por lo que su movimiento de caída se altera significativamente si se hace actuar un campo eléctrico vertical. Ajustando convenientemente la magnitud del campo eléctrico, puede lograrse que la gota permanezca en suspensión.
Conociendo el valor m de la masa de la gota, la intensidad E del campo eléctrico y el valor g de la gravedad, puede calcularse la carga q de la gota en equilibrio:
mg = qE

Millikan comprobó que los valores de las cargas eran siempre múltiplos de una carga elemental, la del electrón. Por consiguiente pudo medir la carga eléctrica que posee un electrón. Este valor es:
e = 1,602 × 10-19 culombios.
Millikan recibió el premio Nobel de Física en 1923 en parte por este experimento.
Modelo de Thomson:


El modelo atómico de Thomson, también conocido como el modelo del pudín, es una teoría sobre la estructura atómica propuesta por Joseph John Thomson, descubridor del electrón, antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como las pasas en un pudín. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una sopa de carga positiva se postulaba con una nube de carga positiva.
Dado que el átomo no deja de ser un sistema material que contiene una cierta cantidad de energía interna, ésta provoca un cierto grado de vibración de los electrones contenidos en la estructura atómica. Desde este punto de vista, puede interpretarse que el modelo atómico de Thomson es un modelo dinámico como consecuencia de la movilidad de los electrones en el seno de la citada estructura.
Si hacemos una interpretación del modelo atómico desde un punto de vista más macroscópico, puede definirse una estructura estática para el mismo dado que los electrones se encuentran inmersos y atrapados en el seno de la masa que define la carga positiva del átomo.
Dicho modelo fue superado tras el experimento de Rutherford, cuando se descubrió el núcleo del átomo. El modelo siguiente fue el modelo atómico de Rutherford.
Dado que el átomo no deja de ser un sistema material que contiene una cierta cantidad de energía interna, ésta provoca un cierto grado de vibración de los electrones contenidos en la estructura atómica. Desde este punto de vista, puede interpretarse que el modelo atómico de Thomson es un modelo dinámico como consecuencia de la movilidad de los electrones en el seno de la citada estructura.
Si hacemos una interpretación del modelo atómico desde un punto de vista más macroscópico, puede definirse una estructura estática para el mismo dado que los electrones se encuentran inmersos y atrapados en el seno de la masa que define la carga positiva del átomo.
Dicho modelo fue superado tras el experimento de Rutherford, cuando se descubrió el núcleo del átomo. El modelo siguiente fue el modelo atómico de Rutherford.
El experimento de Rutherford, también llamado "experimento de la lámina de oro", fue realizado por Hans Geiger y Ernest Marsden en 1909, bajo la dirección de Ernest Rutherford en los Laboratorios de Física de la Universidad de Manchester. Los resultados obtenidos y el posterior análisis tuvieron como consecuencia la rectificación del modelo atómico de Thomson y la propuesta de un modelo nuclear para el átomo.
El experimento consistió en "bombardear" con un haz de partículas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una sustancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él.
En 1911 hará su mayor contribución a la ciencia, al descubrir el núcleo atómico. Había observado en Montreal al bombardear una fina lámina de mica con partículas alfa, que se obtenía una deflexión de dichas partículas. Al retomar Geiger y Marsden de modo más concienzudo estos experimentos y utilizando una lámina de oro, se dieron cuenta de que algunas partículas alfa se desviaban más de 90 grados. Rutherford lanzó entonces la hipótesis, que Geiger y Marsden enfrentaron a las conclusiones de su experimento, de que en el centro del átomo debía haber un "núcleo" que contuviera casi toda la masa y toda la carga positiva del átomo, y que de hecho los electrones debían determinar el tamaño del átomo.
El experimento consistió en "bombardear" con un haz de partículas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una sustancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él.
En 1911 hará su mayor contribución a la ciencia, al descubrir el núcleo atómico. Había observado en Montreal al bombardear una fina lámina de mica con partículas alfa, que se obtenía una deflexión de dichas partículas. Al retomar Geiger y Marsden de modo más concienzudo estos experimentos y utilizando una lámina de oro, se dieron cuenta de que algunas partículas alfa se desviaban más de 90 grados. Rutherford lanzó entonces la hipótesis, que Geiger y Marsden enfrentaron a las conclusiones de su experimento, de que en el centro del átomo debía haber un "núcleo" que contuviera casi toda la masa y toda la carga positiva del átomo, y que de hecho los electrones debían determinar el tamaño del átomo.
En 1913 Niels Bohr, desarrolló su célebre modelo atómico de acuerdo a cuatro postulados fundamentales:
1. Los electrones orbitan el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
2. Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios.
3. El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un único cuanto de luz (fotón) cuya energía corresponde a la diferencia de energía entre ambas órbitas.
4. Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbital L de acuerdo con una simple ecuación.
Basándose en la constante de Planck consiguió cuantizar las órbitas observando las líneas del espectro.
























No hay comentarios:
Publicar un comentario